液体活检|液体活检伴随诊断时代来临,FDA批准F1LCDx新伴随诊断适应症!
液体活检伴随诊断的时代已来临,为什么这么说?下面小编带大家回顾下:
2016年6月1日,FDA批准首款液体活检伴随诊断产品 cobas EGFR Mutation Test v2(罗氏),通过血浆ctDNA检测进而识别受益于厄洛替尼,吉非替尼和奥希替尼治疗的EGFR突变(L858R/19Del)非小细胞肺癌患者。
2019年5月24日,FDA批准第二款液体活检伴随诊断产品 therascreen PIK3CA RGQ PCR Kit(凯杰),通过血浆ctDNA检测进而识别受益于alpelisib治疗的PIK3CA突变乳腺癌患者。
2020年8月7日,FDA批准第三款同时也是首款NGS-based液体活检伴随诊断产品 Guardant360 CDx(Guardant Health,55基因),通过血浆ctDNA检测进而识别受益于奥希替尼治疗的EGFR突变(L858R/19Del/T790M)非小细胞肺癌患者。
2020年8月26日,FDA批准第四款同时也是第二款NGS-based液体活检伴随诊断产品 FoundationOne Liquid CDx(F1LCDx,FMI,324基因),通过血浆ctDNA检测进而识别受益于厄洛替尼,吉非替尼和奥希替尼治疗的EGFR突变(L858R/19Del)非小细胞肺癌患者及识别受益于鲁卡帕利治疗的BRCA1/2突变前列腺癌患者。
2020年10月27日,FDA批准扩大F1CDx的3个新伴随诊断适应症,通过血浆ctDNA检测进而识别受益于alpelisib治疗的PIK3CA突变乳腺癌患者;识别受益于鲁卡帕利治疗的g/sBRCA1/2突变上皮性卵巢癌,输卵管癌或原发性腹膜癌患者;识别受益于阿来替尼治疗的ALK阳性非小细胞肺癌患者。 此外,FDA还批准了F1LCDx的标签扩展,现在允许F1LCDx报告其他3个基因的拷贝数和重排变异。

F1LCDx新增3种伴随诊断适应症
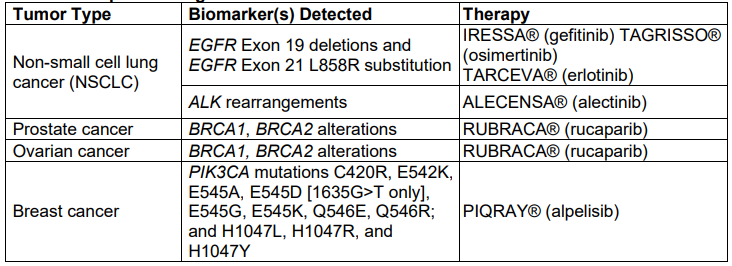
F1LCDx最新伴随诊断适应症
2016年到2020年,液体活检伴随诊断产品的技术平台从RT-PCR-based到NGS-based,基因检测通量越来越大;伴随靶点从最早的EGFR和PIK3CA发展到EGFR/BRCA1/2/PIK3CA/ALK,伴随诊断适应症范围也越来越大。由此可见,液体活检伴随诊断的时代已经来临。
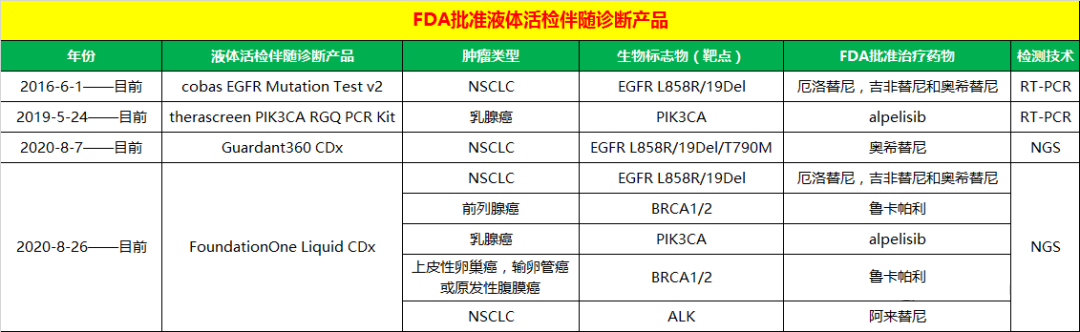
FDA批准的液体活检伴随诊断情况
液体活检伴随诊断的时代虽已来临,但是其面临的假阳性/假阴性问题还是需要去面对和解决:
① 假阳性:液体活检常伴随假阳性的发生,导致假阳性的主要原因是克隆性造血(CHIP)突变,CHIP是一种与年龄相关的造血干细胞血症,造血干细胞获得突变,通过多系造血分化,形成携带同样突变的终末分化成熟血细胞(非恶性),该突变在液体活检时也可以通过cfDNA检测到。在基于ctDNA的液体活检分析中,有必要区分CHIP相关的突变和肿瘤相关的突变,以避免假阳性的发生。

常见CHIP突变基因
② 假阴性:液体活检中假阴性率也很高,这是NCCN指南所明确指出需要注意的地(缺)方(点),该指南指出,不能用液体活检ctDNA检测代替组织学检测。但是,该指南说,在患者无法进行侵入性采样或初始获取的肿瘤组织样本不足以行基因检测时可以使用液体活检进行检测,如果检测是阴性,需考虑再行组织活检。此外,NCCN指南亦指出,研究结果表明,ctDNA检测可以检测到mNSCLC中未发现的突变。
NCCN指南和FDA的批准为ctDNA的临床广泛应用打开了大门。相信在未来,血液液体活检将会取代侵入性组织活检作为一种无痛的方法来确认肿瘤和指导治疗,并将继续作为精准医疗的一部分广泛应用于临床。
此外,随着FDA批准越来越多的液体活检伴随诊断产品,能够缩小中国与美国之间的“教育鸿沟”,使更多的中国临床肿瘤医生能够正确认识和接受肿瘤液体活检技术而不是拒之门外,亦有利于中国肿瘤液体活检产业的发展。(当然,国内液体活检公司依然鱼龙混杂,大家自行鉴别)
参考资料:
1.https://www.foundationmedicine.com/press-releases/d7f17f4f-ab71-4c2b-9b98-bb12df081de1
2.Koo KM, Mainwaring PN. The role of circulating tumor DNA testing in breast cancer liquid biopsies: getting ready for prime time. Future Med. 2020;9(1).
3.NCCN. Clinical Practice Guidelines in Oncology. Non-small cell lung cancer, version 6.2020. Accessed August 17, 2020.
2020年11月23日
ꄘ浏览量:0


